Werner Karl Heisenberg
Werner Karl Heisenberg (Würzburgo, 5 de Dezembro de 1901 — Munique, 1 de Fevereiro de 1976) foi um físico alemão.

Foi laureado com o Nobel de Física e um dos fundadores da Mecânica Quântica.
Doutorou-se pela Universidade de Munique, em 1923 aos 22 anos, e foi o chefe do programa de energia nuclear da Alemanha durante a Segunda Guerra Mundial, apesar da natureza do seu trabalho nesta função ter vindo a ser fortemente debatida, pois Heisenberg lutou toda a sua vida para que a Energia Nuclear não fosse utilizada com fins bélicos.
Em 1924 Heisenberg tornou-se assistente de Max Born no centro universitário de Göttingen, transferiu-se para Copenhague, onde trabalhou com Niels Bohr.
Em 1925 desenvolveu a Mecânica Matricial, o que constituiu o primeiro desenvolvimento da Mecânica Quântica.
Conferência de Solvay de 1927. Na fila superior, Heisenberg é o terceiro a partir da direita.

Em 1927 passou a ensinar física na Universidade de Leipzig, onde enunciou o Princípio da Incerteza ou Princípio de Heisenberg, segundo o qual é impossível medir simultaneamente e com precisão absoluta a posição e a velocidade de uma partícula, isto é, a determinação conjunta do momento e posição de uma partícula, necessariamente, contém erros não menores que a constante de Planck. Esses erros são desprezíveis em âmbito macroscópico, porém se tornam importantes para o estudo de partículas atômicas; as duas grandezas podem ser determinadas exatamente de forma separada, quanto mais exata for uma delas, mais incerta se torna a outra.
Em 1932, Heisenberg recebeu o Nobel de Física pela "criação da mecânica quântica, cuja aplicação possibilitou, entre outras, a descoberta das formas alotrópicas do hidrogênio".
De 1942 a 1945, dirigiu o Instituto Max Planck, Berlim. Durante a Segunda Guerra Mundial trabalhou com Otto Hahn, um dos descobridores da fissão nuclear, no projeto de um reator nuclear. Sendo o lider do programa de construção de bomba atômica dos alemães, o que motivou inclusive Niels Bohr a pôr fim na amizade entre eles.
Heisenberg organizou e dirigiu o Instituto de Física e Astrofísica de Göttingen.
Em 1958, o Instituto de Física e Astrofísica foi mudado para Munique, onde o cientista se concentrou na pesquisa sobre a teoria das partículas elementares, fez descobertas sobre a estrutura do núcleo atômico, da hidrodinâmica das turbulências, dos raios cósmicos e do ferromagnetismo.
Participou da 5ª, 6ª e 7ª Conferência de Solvay.
Princípio da incerteza de Heisenberg
O princípio da incerteza de Heisenberg consiste num enunciado da mecânica quântica, formulado inicialmente em 1927 por Werner Heisenberg, impondo restrições à precisão com que se podem efetuar medidas simultâneas de uma classe de pares de observáveis.
Pode-se exprimir o princípio da incerteza nos seguintes termos:
O produto da incerteza associada ao valor de uma coordenada xi e a incerteza associada ao seu correspondente momento linear pi não pode ser inferior, em grandeza, à constante de Planck normalizada.
Em termos matemáticos, exprime-se assim:
onde
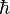
é a Constante de Planck (h) dividida por 2π.
A explicação disso é fácil de entender, e fala mesmo em favor da intuição, embora o raciocínio clássico e os aspectos formais da análise matemática tenham levado os cientistas a pensarem diferentemente por muito tempo.
Quando se quer encontrar a posição de um elétron, por exemplo, é necessário fazê-lo interagir com algum instrumento de medida, direta ou indiretamente. Por exemplo, faz-se incidir sobre ele algum tipo de radiação. Tanto faz aqui que se considere a radiação do modo clássico - constituída por ondas eletromagnéticas - ou do modo quântico - constituída por fótons. Se se quer determinar a posição do elétron, é necessário que a radiação tenha comprimento de onda da ordem da incerteza com que se quer determinar a posição.
Neste caso, quanto menor for o comprimento de onda (maior freqüência) maior é a precisão. Contudo, maior será a energia cedida pela radiação (onda ou fóton) em virtude da relação de Planck entre energia e freqüência da radiação
e o elétron sofrerá um recuo tanto maior quanto maior for essa energia, em virtude do efeito Compton. Como conseqüência, a velocidade sofrerá uma alteração não de todo previsível, ao contrário do que afirmaria a mecânica clássica.
Argumentos análogos poderiam ser usados para se demonstrar que ao se medir a velocidade com precisão, alterar-se-ia a posição de modo não totalmente previsível.
Resumidamente, pode-se dizer que tudo se passa de forma que quanto mais precisamente se medir uma grandeza, forçosamente mais será imprecisa a medida da grandeza correspondente, chamada de canonicamente conjugada.
Algumas pessoas consideram mais fácil o entendimento através da analogia. Para se descobrir a posição de uma bola de plástico dentro de um quarto escuro, podemos emitir algum tipo de radiação e deduzir a posição da bola através das ondas que "batem" na bola e voltam. Se quisermos calcular a velocidade de um automóvel, podemos fazer com que ele atravesse dois feixes de luz, e calcular o tempo que ele levou entre um feixe e outro. Nem radiação nem a luz conseguem interferir de modo significativo na posição da bola, nem alterar a velocidade do automóvel. Mas podem interferir muito tanto na posição quanto na velocidade de um elétron, pois aí a diferença de tamanho entre o fóton de luz e o elétron é pequena. Seria, mais ou menos, como fazer o automóvel ter de atravessar dois troncos de árvores (o que certamente alteraria sua velocidade), ou jogar água dentro do quarto escuro, para deduzir a localização da bola através das pequenas ondas que baterão no objeto e voltarão; mas a água pode empurrar a bola mais para frente, alterando sua posição.
Natureza da medida em mecânica quântica
Como se pode depreender da argumentação acima exposta, a natureza de uma medida sofre sérias reformulações no contexto da mecânica quântica. De fato, na mecânica quântica uma propriedade leva o nome de observável, pois não existem propriedades inobserváveis nesse contexto. Para a determinação de um observável, é necessário que se tenha uma preparação conveniente do aparato de medida, a fim de que se possa obter uma coleção de valores do ensemble de entes do sistema. Se não puder montar, ao menos teoricamente (em um Gedankenexperiment) uma preparação que possa medir tal grandeza (observável), então é impossível determiná-la naquelas condições do experimento.
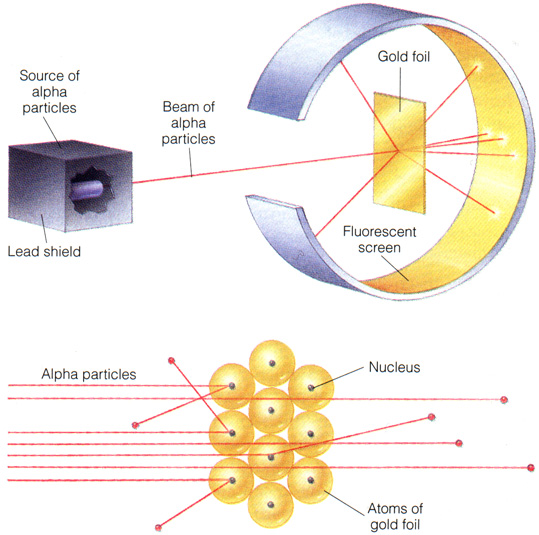
Uma comparação tornará mais clara essa noção. No experimento de difração da dupla fenda, um feixe de elétrons atravessando uma fenda colimadora atinge mais adiante duas outras fendas paralelas traçadas numa parede opaca.
Do lado oposto da parede opaca, a luz, atravessando as fendas simultaneamente, atinge um anteparo. Se puser sobre este um filme fotográfico, obtém-se pela revelação do filme um padrão de interferência de zonas claras e escuras. Esse resultado indica uma natureza ondulatória dos elétrons, resultado esse que motivou o desenvolvimento da mecânica quântica.
Entretanto, pode-se objetar e afirmar-se que a natureza dos elétrons seja corpuscular, ou seja, composta de fótons. Pode-se então perguntar por qual fenda o elétron atravessou para alcançar o anteparo. Para determinar isso, pode-se pôr, junto de cada fenda, uma pequena fonte luminosa que, ao menos em princípio, pode indicar a passagem dos elétrons por tal ou qual fenda. Entretanto, ao fazê-lo, o resultado do experimento é radicalmente mudado. A figura de interferência, antes presente, agora dá lugar a uma distribuição gaussiana bimodal de somente duas zonas claras em meio a uma zona escura, e cujos máximos se situam em frente às fendas.
Isso acontece porque as naturezas ondulatória e corpuscular do elétron não podem ser simultaneamente determinadas. A tentativa de determinar uma inviabiliza a determinação da outra. Essa constatação da dupla natureza da matéria (e da luz) leva o nome de princípio da complementaridade.
Essa analogia serve para mostrar como o mundo microfísico tem aspectos que diferem significativamente do que indica o senso comum.
Para se entender perfeitamente o alcance e o real significado do princípio da incerteza, é necessário que se distingam três tipos reconhecidos de propriedades dinâmicas em mecânica quântica:
- Propriedades compatíveis: são aquelas para as quais a medida simultânea e arbitrariamente precisa de seus valores não sofre nenhum tipo de restrição básica. Exemplo: a medição simultânea das coordenadas x, y e z de uma partícula. A medição simultânea dos momentos px,py e pz de uma partícula.
- Propriedades mutuamente excludentes: são aquelas para as quais a medida simultânea é simplesmente impossível. Exemplo: se um elétron está numa posição xi, não pode estar simultaneamente na posição diferente xj.
- Propriedades incompatíveis: são aquelas correspondentes a grandezas canonicamente conjugadas, ou seja, aquelas cujas medidas não podem ser simultaneamente medidas com precisão arbitrária. Em outras palavras, são grandezas cujas medidas simultâneas não podem ser levadas a cabo em um conjunto de subsistemas identicamente preparados (ensemble) para este fim, porque tal preparo não pode ser realizado. Exemplos: as coordenadas x,y e z e seus correspondentes momentos px,py e pz, respectivamente. As coordenadas angulares θi e os correspondentes momentos angulares Ji.
Observáveis e operadores
No formalismo matemático da mecânica quântica, os observáveis são representados por operadores matemáticos sobre um espaço de Hilbert.
Esses operadores podem ser construídos a partir de seus equivalentes clássicos.
Na formulação de Heisenberg, as relações da incerteza podem ser dadas na forma de um operador comutador, que opera sobre dois outros operadores quaisquer:
onde A e B são operadores quaisquer.
No caso das relações de incerteza:
Dirac notou a semelhança formal entre o comutador e os parênteses de Poisson. Sabedor da equivalência usada por Schrödinger quando este postulou a forma da equação de onda, Dirac postulou as seguintes equivalências, que valem como receita para se acharem os operadores quânticos correspondentes a grandezas clássicas:
A descrição ondulatória dos objetos microscópicos tem consequências teóricas importantes, como o principio da incerteza de Heisenberg. O fato de os objetos microscópicos, em muitas situações, terem uma localização no espaço mesmo que aproximada, implica que não podem ser descritos por uma onda com um só comprimento de onda (onda plana), pois esta ocuparia todo o espaço. É necessária uma superposição de comprimentos de ondas diferentes para se obter um "pacote" de ondas mais bem localizado e que represente o objeto microscópico.
O papel do princípio da incerteza nas formulações modernas da mecânica quântica
Hoje em dia, o princípio da incerteza é importante principalmente por dois motivos: um histórico e outro didático. Ambos são análogos: o princípio da incerteza mostra de maneira clara que concepções clássicas a respeito da medida devem ser abandonadas.
No entanto, o princípio da incerteza *não* é um bom princípio (ou postulado) da mecânica quântica, já que é inexato e pouco geral. A mecânica quântica não-relativística é totalmente descrita com alguns postulados, dos quais as relações de incerteza de Heisenberg surgem de forma pouco natural. Mas o espírito do princípio da incerteza é mantido: não se pode ter um sistema que, ao ser medido, tenha a probabilidade 1 de se encontrar tanto uma ou outra grandeza, se essas grandezas corresponderem a operadores que não comutam. Iremos explicar isto melhor adiante:
Todas as grandezas que podem ser medidas correspondem aos chamados "autovalores" de certos objetos matemáticos chamados de operadores (na verdade, a natureza requer que esses operadores sejam de uma classe especial, a dos "observáveis"). Chamemos um operador qualquer de A, e chamemos seus autovalores de a_n (a_1 é um autovalor, a_2 é outro e assim por diante). Existem estados quânticos, chamados "autoestados" (que representaremos por | φn > ) do operador A, nos quais uma medida tem 100% de chance de encontrar o valor a_n. Esses autoestados e esses autovalores são definidos pela seguinte equação:
A | φn > = an | φn >
Um operador é dito um observável se esses autoestados φn > formarem uma "base". Diz-se que um grupo qualquer de estados quânticos forma uma base se qualquer outro estado quântico puder ser escrito como uma superposição deles. Ou seja, para qualquer estado quântico | Ψ > ,
onde os coeficientes cn, em geral complexos, indicam o quanto os autoestados correspondentes | φn > influenciam no estado resultante, | Ψ > . Um dos postulados da mecânica quântica diz que a probabilidade de uma medida da grandeza A revelar o valor a_n é:
P(an) = | cn | 2
Quando o sistema está no autoestado | φn >, o postulado acima mostra que a probabilidade de se encontrar o valor a_n correspondente é 100%. Assim, pode-se dizer que o sistema *possui a grandeza A bem definida*.
Agora consideremos dois operadores A e B, como o operador da posição e o operador do momento. Em geral, os autoestados de um operador não são os mesmos autoestados do outro operador. Consequentemente, se o sistema está em um estado quântico onde a grandeza A é bem definida, a grandeza B não será bem definida. Ou seja, haverá uma "incerteza" na grandeza B.
Mas, e se o sistema estiver num estado onde a grandeza A é bem definida, e efetuarmos uma medida na grandeza B? Pode-se pensar que, então, saberemos exatamente o valor de ambas as grandezas. Mas isso está errado, devido a outro dos postulados da mecânica quântica: se uma medida de uma grandeza qualquer B revela o valor b_n, então o sistema *é perturbado pela medida*, e passa para o autoestado | φn > correspondente à grandeza B_n.
Então, suponha que dois operadores A e B não possuem os mesmos autoestados. Se efetuarmos em um sistema qualquer a medida da grandeza A, e encontrarmos um certo valor, o sistema se torna um autoestado de A, com um valor bem definido de A e uma incerteza no valor de B. Se, após isso, efetuarmos uma medida no valor de B, então lançamos o sistema num autoestado de B, com um valor bem definido de B e uma incerteza no valor de A. Com isso, dizemos que é impossível saber simultaneamente o valor da grandeza A e da grandeza B.
A incerteza entre a posição e o momento proposta por Heisenberg é, então, uma consequência dos postulados da mecânica quântica, e não um postulado por si só.
Imagens abaixo relacionadas ao princípio da incerteza:

Fonte: http://pt.wikipedia.org/wiki/Princ%C3%ADpio_da_incerteza_de_Heisenberg
http://pt.wikipedia.org/wiki/Werner_Heisenberg
 No século V a.C. Leucipo de Mileto (foto à esquerda),nascimento cerca de 500 a.C., juntamente a seu discípulo Demócrito de Abdera (cerca de 460 a.C. - 370 a.C.), considerado o pai do atomismo grego, discorreram sobre a natureza da matéria de forma elegante e precisa. Eles afirmavam que toda matéria era constituída por minúsculas partículas, às quais deram o nome de átomos. Essa idéia foi rejeitada por Platão e Aristóteles, que tinham muito maior influência na época. Aristóteles foi um dos maiores lógicos de todos os tempos. Este reviveu e fortaleceu o modelo de matéria contínua, ou seja, a matéria como "um inteiro".
No século V a.C. Leucipo de Mileto (foto à esquerda),nascimento cerca de 500 a.C., juntamente a seu discípulo Demócrito de Abdera (cerca de 460 a.C. - 370 a.C.), considerado o pai do atomismo grego, discorreram sobre a natureza da matéria de forma elegante e precisa. Eles afirmavam que toda matéria era constituída por minúsculas partículas, às quais deram o nome de átomos. Essa idéia foi rejeitada por Platão e Aristóteles, que tinham muito maior influência na época. Aristóteles foi um dos maiores lógicos de todos os tempos. Este reviveu e fortaleceu o modelo de matéria contínua, ou seja, a matéria como "um inteiro".














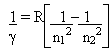





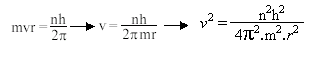
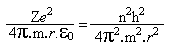
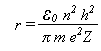
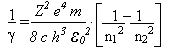
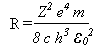



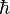 é a Constante de Planck (h) dividida por 2π.
é a Constante de Planck (h) dividida por 2π.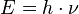
![[A,B] \equiv AB - BA](http://upload.wikimedia.org/math/8/7/c/87c57d02df8655e838ab1f5cb596f66a.png)
![[X_k,B_l] = i\hbar\delta_{kl}\mathbb{I}](http://upload.wikimedia.org/math/1/e/d/1ed89fb6c488440712ed4ad7ea0bee48.png)


![\left \{x_k,p_l\right\}\to \frac{1}{i\ \hbar}\cdot \left[X_k,P_l\right]](http://upload.wikimedia.org/math/4/7/c/47cf3f71be3cbd626dc4fc450b736ac2.png)


