Niels Bohr
 Niels Henrick David Bohr (Copenhague, 7 de Outubro de 1885 — Copenhague, 18 de Novembro de 1962) foi um físico dinamarquês cujos trabalhos contribuíram decisivamente para a compreensão da estrutura atômica e da física quântica.
Niels Henrick David Bohr (Copenhague, 7 de Outubro de 1885 — Copenhague, 18 de Novembro de 1962) foi um físico dinamarquês cujos trabalhos contribuíram decisivamente para a compreensão da estrutura atômica e da física quântica. O seu pai, Christian Bohr, foi professor de fisiologia, e sua mãe, Ellen (nome de solteira Adler), provinha de uma família judaica.
 Licenciou-se na sua cidade natal em 1911 e trabalhou com Joseph John Thomson e Ernest Rutherford na Inglaterra. Em 1913, aplicando a teoria da quantificação aos elétrons do modelo atômico de Rutherford, conseguiu interpretar algumas das propriedades das séries espectrais do hidrogênio e a estrutura do sistema periódico dos elementos. Formulou o princípio da correspondência e, em 1928, o da complementaridade. Estudou ainda o modelo nuclear da gota líquida, e antes da descoberta do plutônio, previu a propriedade da cisão, análoga à do U-235. Bohr recebeu o Nobel de Física em 1922.
Licenciou-se na sua cidade natal em 1911 e trabalhou com Joseph John Thomson e Ernest Rutherford na Inglaterra. Em 1913, aplicando a teoria da quantificação aos elétrons do modelo atômico de Rutherford, conseguiu interpretar algumas das propriedades das séries espectrais do hidrogênio e a estrutura do sistema periódico dos elementos. Formulou o princípio da correspondência e, em 1928, o da complementaridade. Estudou ainda o modelo nuclear da gota líquida, e antes da descoberta do plutônio, previu a propriedade da cisão, análoga à do U-235. Bohr recebeu o Nobel de Física em 1922.A sua teoria para a explicação do modelo atômico proposto por Rutherford em 1911, levando em conta a teoria quântica (formulada por Max Planck em 1900), não foi levada a sério. Depois, no decorrer da década e da década de 1920, vários físicos ajudaram a criar o modelo existente hoje. Entre estes físicos podemos citar Einstein, De Broglie, Schrödinger, Heisenberg, De Pauli, entre outros.
Modelo atômico de Bohr
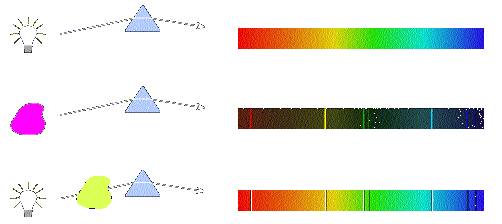
Quando átomos são aquecidos ou submetidos a uma descarga elétrica, eles absorvem energia, que em seguida é emitida como radiação. Por exemplo, se o cloreto de sódio é aquecido na chama de Bunsen, serão produzidos átomos de sódio, que dão origem a uma coloração amarela característica na chama, produzindo linhas espectrais descontínuas em aparelhos específicos. Essa luz emitida pelos átomos podem ser estudadas em espectrômetros, verificando-se que elas são constituídas por linhas com diferentes comprimentos de onda.
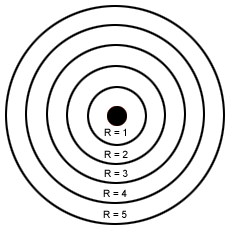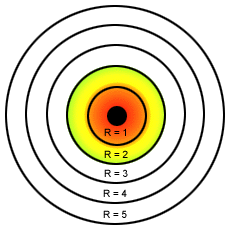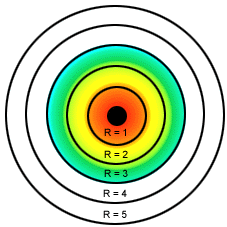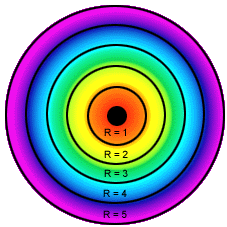
Órbitas de Bohr para o átomo de hidrogênio
O matemático Rydberg, propôs uma equação empírica relacionada às linhas espectrais:
onde R é um valor constante determinado por Rydberg, chamada de constante de Rydberg.
É somente válida para o espectro do hidrogênio a equação acima.
Na época que Rutherford publicou seu modelo já existiam conceitos físicos consagrados e um destes conceitos era a Lei do Eletromagnetismo de Maxwell que dizia: "Toda carga elétrica em movimento acelerado em torno de outra perde energia sob forma de ondas eletromagnéticas". Como o elétron é uma carga elétrica em movimento acelerado em torno do núcleo, perderia energia e se aproximaria do núcleo até chocar-se com este; desta forma o átomo se auto-destruiria.
Em 1913 Bohr afirmou que os fenômenos atômicos não poderiam ser explicados pelas Leis da Física Clássica.
Niels Bohr, dinamarquês, contribuiu para o aperfeiçoamento do modelo atômico de Rutherford. Baseado na teoria quântica, Bohr explicou o comportamento dos elétrons nos átomos. Para Bohr, os elétrons giram em torno do núcleo de forma circular e com diferentes níveis de energia. Seus postulados:
- Os elétrons nos átomos descrevem sempre órbitas circulares ao redor do núcleo positivo, chamadas de camadas ou níveis de energia;
- A eletrosfera está dividida em camadas ou níveis eletrônicos, e os elétrons nessas camadas, apresentam energia constante;
- Em sua camada de origem (camada estacionária) a energia é constante, mas o elétron pode saltar para uma camada mais externa, sendo que, para tal é necessário que ele ganhe energia externa;
- Os elétrons só podem ocupar os níveis que tenham uma determinada quantidade de energia.
- Os elétrons podem saltar de um nível para outro mais externo, desde que absorvam uma quantidade bem definida de energia (quantum de energia).

- Ao voltar ao nível mais interno, o elétron emite um quantum de energia, na forma de luz de cor bem definida ou outra radiação eletromagnética (fóton).

- Cada órbita é denominada de estado estacionário e pode ser designada por letras K, L, M, N, O, P, Q. As camadas podem apresentar:
K = 2 elétrons
L = 8 elétrons
M = 18 elétrons
N = 32 elétrons
O = 32 elétrons
P = 18 elétrons
Q = 2 elétrons
L = 8 elétrons
M = 18 elétrons
N = 32 elétrons
O = 32 elétrons
P = 18 elétrons
Q = 2 elétrons
- Cada nível de energia é caracterizado por um número quântico (n), que pode assumir valores inteiros: 1, 2, 3, etc.
A energia recebida corresponde a um quantum e é dada por E = h.f , em que:
Explicação em português sobre o Modelo de Bohr
E = energia do quantum h = constante de Planck f = freqüência da radiação
Para que um elétron permaneça em sua órbita, a atração eletrostática entre o núcleo e o elétron, que tende a puxar o elétron em direção ao núcleo dever ser igual a força centrífuga, que tende a afastar o elétron. Para um elétron de massa m, movendo-se com uma velocidade v numa órbita de raio r, temos que:
(fórmula da física clássica)
Se e for a carga do elétron, Z a carga do núcleo e ε0a permissividade no vácuo, então:
De modo que:
E portanto (equação ***)
De acordo com a teoria quântica de Planck, a energia não é contínua, mas discreta (pacotes de energia). isso significa que a energia de um elétron numa órbita, isto é, seu momento angular mvr, deve ser igual a um número inteiro n de quanta.
Combinando-se essa equação, com a equação ***, temos que
E portanto
Substituindo o valor das constantes, temos r = 5,292x10-11m, para n = 1. Assim, variando valor de n, teremos uma imagem do átomo de hidrogênio em que o elétron se move em órbitas circulares. O átomo emitirá ou absorverá energia somente ao passar de uma órbita para outra.
Com um pouco de habilidade e paciência, rearranjamos as fórmulas acima e temos:
Ou seja, Bohr conseguir obter a empírica equação de Rydberg através de conceitos clássicos e quânticos ao mesmo tempo, onde a constante R de Rydberg é
O valor experimental de R é 1,097373x107m-1 em boa concordância com o valor teórico de 1,096776x107m-1. A teoria de Bohr fornece uma explicação para o espectro do hidrogênio. As diferentes séries de linhas espectrais podem ser obtidas variando os valores de n12 e n22 na equação acima.
Explicação em português sobre o Modelo de Bohr
Fonte: http://www.vestibulandoweb.com.br/quimica/teoria/modelo-atomico.asp
http://www.algosobre.com.br/fisica/modelos-atomicos.html
http://www.portalsaofrancisco.com.br/alfa/modelo-atomico-de-bohr/modelo-atomico-de-bohr-1.php
http://pt.wikipedia.org/wiki/Niels_Bohr

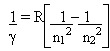



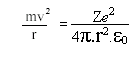
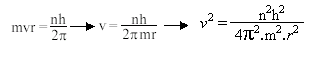
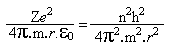
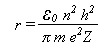
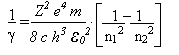
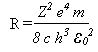
Nenhum comentário:
Postar um comentário